> 14 novembre 2018
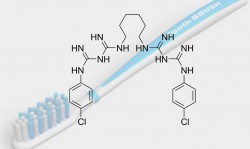
A la fois principe actif médicamenteux et additif permettant la conservation des médicaments ou des cosmétiques, la chlorhexidine est une molécule fréquemment employée dans le domaine des produits de santé. Depuis que les parabens sont regardés avec méfiance par une certaine partie de la population, l’industrie se tourne vers des substituts. Est-ce à tort ou à raison, c’est la question que nous nous posons, aujourd’hui.
La chlorhexidine, une molécule avec un large spectre d’action
La chlorhexidine est un bisbiguanide cationique qui possède une substantivité importante pour la peau et la muqueuse buccale. Son efficacité dans le domaine de l’hygiène bucco-dentaire par inhibition de la formation de la plaque dentaire est bien documentée et ce depuis une cinquantaine d’années.1 Cette molécule exerce un effet bactériostatique à faible dose et un effet bactéricide à dose plus élevée. Un large spectre d’action (efficacité vis-à-vis des bactéries Gram+ et Gram-) lui est reconnu.2,3 On a connaissance, depuis une vingtaine d’années, de son effet amibicide, en particulier, à l’encontre d’Acanthamoeba, un agent responsable de kératite oculaire.4
La chlohexidine, ses caractéristiques physico-chimiques
La chlohexidine est une molécule quasiment insoluble dans l’eau à 20°C. « La solubilité dans l’eau croît en passant du chlorhydrate (presque insoluble) à l’acétate (légèrement soluble) et au gluconate soluble jusqu’à 70 % ».3 On a donc recours à ses sels dans le domaine cosmétique (crèmes diverses, solutions anti-plaque, déodorants et anti-transpirants) ou pharmaceutique (collyres, bains de bouche, produits antiseptiques).
La chlorhexidine, la molécule-phare du domaine bucco-dentaire
La chlorhexidine peut être utilisée afin d’inhiber la formation de la plaque dentaire. On n’observe pas de différence d’efficacité entre les dosages de 0,20 et de 0,12 %.5
En ce qui concerne l’effet préventif de l’érosion dentaire (perte de substance non liée à une colonisation bactérienne) par la chlorhexidine, les avis sont partagés. Si certains considèrent que 0,12 % de chlorhexidine (associé à 0,61 % de thé vert) est une dose qui permet d’avoir une efficacité comparable à celle de l’ion fluorure à 250 ppm, du point de vue de la minéralisation de l’émail dentaire,6 d’autres considèrent que la prise en charge de lésions cervicales non carieuses par le biais de bain de bouche à la chlorhexidine se solde par un échec.7
On a démontré récemment qu’un métabolite de la chlorhexidine, la p-chloroaniline, pouvait être retrouvé dans des bains de bouche ; ce métabolite carcinogène peut également être détecté dans la salive de patients ayant réalisé des bains de bouche avec une solution de chlorhexidine à 0,2 %, pendant une durée de 30 secondes. Ceci explique pourquoi la FDA conseille de restreindre l’utilisation des bains de bouche pour une durée de 6 mois maximum.8
La chlorhexidine, une molécule utile pour la désinfection du matériel médical
La membrane du stéthoscope peut être à l’origine de contaminations croisées. On retrouve, effectivement, à sa surface un certain nombre de germes. On trouve, en particulier, du staphylocoque doré (dans plus de 85 % des cas) résistant à la méticilline dans 20 à 40 % des cas. Afin de diminuer le risque de contamination, la désinfection de ce type de matériel en ayant recours à la chlorhexidine est une bonne solution.9
La chlorhexidine, une molécule caractérisée par un faible taux de pénétration
Si l’on en croit François Dorvault, « l’absorption cutanée par la peau normale peut être considérée comme nulle ». Si l’on veut obtenir des renseignements plus précis, il convient de se pencher sur les travaux effectués par Christine Lafforgue, à la fin des années 1990. On se rend alors compte que la diffusion de la chlorhexidine au niveau des différentes couches cutanées n’est pas nulle. Elle correspond à 0,01 % de la dose initiale dans le cas d’une peau saine et à 0,87 % de la dose initiale dans le cas d’une peau excoriée, dans le cas précis d’un temps de contact de 48 h.10
La chlorhexidine, quels effets indésirables associés ?
Le gluconate de chlorhexidine est très largement utilisé en milieu hospitalier. Des solutions aqueuses ou alcooliques (éthanol, alcool isopropylique) à différents titres (0,25 %, 0,50 %, 1,00 %, 2,00 % et 4,00 %) sont préconisées pour l’aseptisation de la peau de l’adulte ou de l’enfant de plus de 2 mois, en cas de mise en place de dispositifs médicaux intravasculaires, par exemple. En néonatalogie, la situation est un peu compliquée dans la mesure où, chez les prématurés, des brûlures chimiques pouvant mettre la vie en danger de l’enfant, ont parfois été observées.11, 12
La chlorhexidine est utilisée pour la désinfection de la peau avant une intervention chirurgicale ou en post-opératoire, à des fins d’aseptisation des plaies. On constate dans ce cas qu’elle est susceptible d’engendrer des irritations, des allergies et des réactions anaphylactiques chez les patients traités par cet antiseptique.13,14 En obstétrique, on remarque que la chlorhexidine à 2 % utilisée en pré-opératoire est mieux tolérée (du point de vue d’un effet irritant) que la povidone iodée à 7,5 %.15 En ophtalmologie, on a commencé par utiliser la chlorhexidine pour la désinfection des lentilles souples, puis on a étendu son emploi au domaine de la désinfection dans le cadre d’actes chirurgicaux. Parfois controversée dans cette application, la chlorhexidine s’avère, toutefois, efficace et bien tolérée.16
Dans le cadre de l’aseptisation de la bouche, on observe différents effets indésirables. Un phénomène d’agueusie (perte du goût) ou de modification du goût et ce en particulier à l’égard de la sensation « salée » est fréquemment évoqué. Les mets apparaissent alors insipides ou bien amers.17 On note également des sensations de brûlures de la muqueuse buccale, de sécheresse, de décoloration de la langue et/ou des dents, de desquamation.18 En ce qui concerne les modifications de couleur affectant les dents, certains auteurs parlent de décoloration, d’autres de coloration selon une palette de couleurs allant du jaune au marron en passant par le gris.19
Si à l’heure actuelle, on constate peu de cas d’allergie à la chlorhexidine (prévalence de 0,1 %), certains auteurs précisent que celle-ci se manifeste après une utilisation répétée de longue durée. On peut constater chez les personnes sensibilisées des phénomènes d’allergie, suite à l’utilisation de cosmétiques en renfermant. Thimoty Watts met ainsi en garde ses patients vis-à-vis de la chlorhexidine « cachée » dans des produits d’hygiène ou de soin.20 On note également que la prévalence est beaucoup plus élevée chez le patient atopique (prévalence de l’ordre de 6 %).21
La désinfection des mains à l’aide de solutions de chlorhexidine n’est pas jugée utile pour les mêmes raisons.22 L’augmentation du nombre de produits cosmétiques renfermant de la chlorhexidine risque d’avoir un impact sur le nombre de cas d’allergie répertoriés.23
Ce que l’on doit savoir en formulation
Il est bon de se rappeler que « l’activité de la chlorhexidine est diminuée avec les savons, les détergents anioniques et surfactifs non ioniques, avec les matières organiques », qu’elle est optimale à « pH neutre ou légèrement acide ».3
Certains auteurs ont également observé un phénomène de précipitation lorsqu’on l’associe à l’EDTA. Cette information intéressante parue dans la littérature scientifique en 2008 semble assez peu connue. Cette réaction de précipitation ne s’accompagne pas, vraisemblablement, de dégradation chimique de la molécule.24 Il conviendra, toutefois, d’éviter ce type d’association.
La chlorhexidine, sachons l’utiliser à bon escient
Le rejet de chlorhexidine dans les canalisations n’est pas sans risque pour l’environnement.2 Il serait donc pertinent de réserver la chlorhexidine aux formes à usage bucco-dentaire et d’éviter de l’utiliser en tant que conservateur dans un trop grand nombre de formules. La chlorhexidine est un antiseptique qui occupe une place de choix en milieu hospitalier ; ne venons pas semer la zizanie en en faisant un ingrédient cosmétique ubiquitaire.
Dans ce contexte, on évitera donc les produits qui en contiennent. A titre d’exemples, on en retrouve dans un certain nombre de produits du groupe L’Oréal, tels que les produits Lipikar ou Iso-Urea (La Roche-Posay) ou encore Elsève.
La chlorhexidine restera donc, si l’on veut bien suivre nos conseils, dans le verre à dent (à utiliser avec modération, durant de courtes périodes et en respectant scrupuleusement les dates de péremption) ou dans l’arsenal médical et ne sera pas privilégié en tant que conservateur antimicrobien.
Compositions
Lipikar lait : AQUA / WATER, BUTYROSPERMUM PARKII BUTTER / SHEA BUTTER, GLYCERIN, SORBITAN STEARATE, PARAFFINUM LIQUIDUM / MINERAL OIL, NIACINAMIDE, BRASSICA CAMPESTRIS OLEIFERA OIL / RAPESEED SEED OIL, ALUMINUM STARCH OCTENYLSUCCINATE, DIMETHICONE, CERA ALBA / BEESWAX, SORBITAN TRISTEARATE, CARBOMER, SODIUM HYDROXIDE, POLOXAMER 338, AMMONIUM POLYACRYLOYLDIMETHYL TAURATE, DISODIUM EDTA, SUCROSE COCOATE, CAPRYLYL GLYCOL, CITRIC ACID, T-BUTYL ALCOHOL, CETYL PALMITATE, BHT, PENTAERYTHRITYL TETRA-DI-T-BUTYL, HYDROXYHYDROCINNAMATE, CHLORHEXIDINE DIGLUCONATE, PARFUM / FRAGRANCE
Lotion apaisante physiologique : AQUA / WATER, PEG-8, GLYCERIN, PEG-60 HYDROGENATED CASTOR OIL, POLOXAMER 124, CITRIC ACID, CHLORHEXIDINE DIGLUCONATE, PARFUM / FRAGRANCE
Hydreane riche : AQUA / WATER, GLYCERIN, CETEARYL ALCOHOL, ISOHEXADECANE, GLYCERYL STEARATE, CYCLOHEXASILOXANE, CAPRYLIC/CAPRIC/SUCCINIC TRIGLYCERIDE, PETROLATUM, BUTYROSPERMUM PARKII BUTTER / SHEA BUTTER, PEG-100 STEARATE, GLYCINE SOJA OIL / SOYBEAN OIL, CETEARETH-20, CAPRYLYL GLYCOL, CITRIC ACID, POLYPHOSPHORYLCHOLINE GLYCOL ACRYLATE, TOCOPHEROL, CHLORHEXIDINE DIGLUCONATE, PARFUM / FRAGRANCE
Lait lissant Iso-Urea : AQUA, BUTYROSPERMUM PARKII BUTTER, GLYCERIN, DIMETHICONE, UREA, PARAFFINUM LIQUIDUM, SODIUM LACTATE, CETEARYL ALCOHOL, PEG-100 STEARATE, GLYCERYL STEARATE, PROPYLENE GLYCOL, GLYCINE, STEARIC ACID, DIMETHICONOL, SODIUM HYDROXIDE, PALMITIC ACID, DISODIUM EDTA, HYDROXYETHYLPIPERAZINE ETHANE SULFONIC ACID, XANTHAN GUM, ACRYLATES/C10-30 ALKYL ACRYLATE CROSSPOLYMER, TOCOPHEROL, PHENOXYETHANOL, CHLORHEXIDINE DIGLUCONATE, PARFUM
Elsève argile extraordinaire : AQUA / WATER, CETEARYL ALCOHOL, BEHENTRIMONIUM CHLORIDE, GLYCINE SOJA OIL / SOYBEAN OIL, CETYL ESTERS, SODIUM HYALURONATE, PHENOXYETHANOL, ARGILLA / MAGNESIUM ALUMINUM SILICATE, CHLORHEXIDINE DIHYDROCHLORIDE, SALICYLIC ACID, LINALOOL, BENZYL ALCOHOL, BENZYL SALICYLATE, MONTMORILLONITE, ISOPROPYL ALCOHOL, KAOLIN, ALPHA-ISOMETHYL IONONE, GERANIOL, BHT, CITRIC ACID, CITRONELLOL, HEXYL CINNAMAL, GLYCERIN, PARFUM / FRAGRANCE
Elsève Liss-intense après-shampooing démêlant : AQUA / WATER, CETEARYL ALCOHOL, AMODIMETHICONE, POTATO STARCH MODIFIED, BEHENTRIMONIUM CHLORIDE, CI 47005 / ACID YELLOW 3, CI 14700 / RED 4, DODECENE, PHENOXYETHANOL, ARGANIA SPINOSA OIL / ARGANIA SPINOSA KERNEL OIL, TRIDECETH-6, CHLORHEXIDINE DIHYDROCHLORIDE, POLOXAMER 407, XYLOSE, CAMELINA SATIVA OIL / CAMELINA SATIVA SEED OIL, LIMONENE, LINALOOL, BENZYL ALCOHOL, BENZYL SALICYLATE, ISOPROPYL ALCOHOL, CETYL ESTERS, CITRIC ACID, CETRIMONIUM CHLORIDE, BUTYLPHENYL METHYLPROPIONAL, CITRONELLOL, BHT, LAURYL PEG/PPG-18/18 METHICONE, HEXYL CINNAMAL, AMYL CINNAMAL, PARFUM / FRAGRANCE
Bibliographie
1 Jill A. Helms, Mary Anne Della-Fera, April E. Mott, Marion E. Frank, Effects of chlorhexidine on human taste perception, Archives of Oral Biology, 40, 10, 1995, Pages 913-920
2 Ranjana Das, Sanjana Ghosh, Chiranjib Bhattacharjee, A green practice for pharmaceutical drug chlorhexidine digluconate treatment and ecotoxicity assessment, Journal of Water Process Engineering, 7, 2015, Pages 266-272
3 François Dorvault, L'Officine, Vigot, Paris, 1995, 2089 pages
4 Shu-Chiao Lin, Chih-Fen Huang, Li-Jiuan Shen, Hsueh-Ju Wang, Fe-Lin Lin Wu, Formulation and stability of an extemporaneous 0.02% chlorhexidine digluconate ophthalmic solution, Journal of the Formosan Medical Association, 114, 12, 2015, Pages 1162-1169
5 Daljit Kapoor, Navjot Kaur, Tarun Nanda, Efficacy of two different concentrations of chlorhexidine mouth-rinse on plaque re-growth, Indian Journal of Dentistry, 2, 2, 2011, Pages 11-15
6 Ana Carolina Magalhães, Annette Wiegand, Daniela Rios, Angélica Hannas, Marília Afonso Rabelo Buzalaf, Chlorhexidine and green tea extract reduce dentin erosion and abrasion in situ, Journal of Dentistry, 37, 12, 2009, Pages 994-998
7 V. P. A. Saboia, M. S. R. G. Araújo, L. C. Souza, F. M. Apolônio, A. D. Loguércio, Two-year clinical evaluation of primers containing chlorhexidine digluconate, Dental Materials, 30, Suppl 1, 2014, Pages e126-e127
8 H. Below, O. Assadian, R. Baguhl, U. Hildebrandt, A. Kramer, Measurements of chlorhexidine, p-chloroaniline, and p-chloronitrobenzene in saliva after mouth wash before and after operation with 0.2% chlorhexidine digluconate in maxillofacial surgery: a randomised controlled trial, British Journal of Oral and Maxillofacial Surgery, 55, 2, 2017, Pages 150-155
9 José A. Álvarez, Susana R. Ruíz, Juan L. Mosqueda, Ximena León, Juan H. Macias, Decontamination of stethoscope membranes with chlorhexidine: Should it be recommended?, American Journal of Infection Control, 44, 11, 2016, Pages e205-e209
10 C. Lafforgue, L. Carret, F. Falson, M. E. Reverdy, J. Freney, Percutaneous absorption of a chlorhexidine digluconate solution, International Journal of Pharmaceutics, 147, 2, 1997, Pages 243-246
11 Mariano Paternoster, Massimo Niola, Vincenzo Graziano, Avoiding Chlorhexidine Burns in Preterm Infants, Journal of Obstetric, Gynecologic & Neonatal Nursing, 46, 2, 2017, Pages 267-271
12 Iria Neri, Giulia Maria Ravaioli, Giacomo Faldella, Maria Grazia Capretti, Annalisa Patrizi, Chlorhexidine-Induced Chemical Burns in Very Low Birth Weight Infants, The Journal of Pediatrics, 191, 2017, Pages 262-265.e2
13 Daryl S. Paulson, Robert Topp, Robert E. Boykin, Gregory Schultz, Qingping Yang, Efficacy and safety of a novel skin cleansing formulation versus chlorhexidine gluconate, American Journal of Infection Control, 46, 11, 2018, Pages 1262-1265
14 Erna Snellman, Tapio Rantanen, Severe anaphylaxis after a chlorhexidine bath, Journal of the American Academy of Dermatology, 40, 5, 1999, Pages 771-772
15 Ahmed Al-Niaimi, Laurel W. Rice, Uppal Shitanshu, Bonnie Garvens, Nasia Safdar, Safety and tolerability of chlorhexidine gluconate (2%) as a vaginal operative preparation in patients undergoing gynecologic surgery, American Journal of Infection Control, 44, 9, 2016, Pages 996-998
16 Rohan Merani, Zachary E. McPherson, Alan P. Luckie, Jagjit S. Gilhotra, Peter E. Davies, Aqueous Chlorhexidine for Intravitreal Injection Antisepsis: A Case Series and Review of the Literature, Ophthalmology, 123, 12, 2016, Pages 2588-2594
17 Marion E Frank, Janneane F Gent, Thomas P Hettinger, Effects of chlorhexidine on human taste perception, Physiology & Behavior, 74, 1–2, 2001, Pages 85-99
18 H. U. Hepsø, T. Bjørnland, L. A. Skoglund, Side-effects and patient acceptance of 0.2% versus 0.1% chlorhexidine used as postoperative prophylactic mouthwash, International Journal of Oral and Maxillofacial Surgery, 17, 1, 1988, Pages 17-20
19 Antonio Bascones-Martínez, Marta Muñoz-Corcuera, Cristina Bascones-Ilundain, Sideeffects of drugs on the oral cavity, Medicina Clínica (English Edition),144, 3, 2015, Pages 126-131
20 Timothy J. Watts, Philip H. Li, Kok Loong Ue, Rubaiyat Haque, Chronic Allergic Contact Dermatitis Due to Chlorhexidine, The Journal of Allergy and Clinical Immunology: In Practice, 6, 1, 2018, Pages 254-255
21 Supriya Rastogi, Kevin R. Patel, Vivek Singam, Jonathan I. Silverberg, Allergic contact dermatitis to personal care products and topical medications in adults with atopic dermatitis, Journal of the American Academy of Dermatology, In press, corrected proof, Available online 25 July 2018
22 Günter Kampf, What is left to justify the use of chlorhexidine in hand hygiene?, Journal of Hospital Infection, 70, Suppl 1, 2008, Pages 27-34
23 David Spoerl, Peter Jandus, Thomas Harr, Pitfalls and peculiarities in chlorhexidine allergy, The Journal of Allergy and Clinical Immunology: In Practice, 4, 5, 2016, Pages 991-992
24 Brian J. Rasimick, Michelle Nekich, Megan M. Hladek, Barry L. Musikant, Allan S. Deutsch, Interaction between Chlorhexidine Digluconate and EDTA, Journal of Endodontics, 34, 12, 2008, Pages 1521-1523
1 Jill A. Helms, Mary Anne Della-Fera, April E. Mott, Marion E. Frank, Effects of chlorhexidine on human taste perception, Archives of Oral Biology, 40, 10, 1995, Pages 913-920
2 Ranjana Das, Sanjana Ghosh, Chiranjib Bhattacharjee, A green practice for pharmaceutical drug chlorhexidine digluconate treatment and ecotoxicity assessment, Journal of Water Process Engineering, 7, 2015, Pages 266-272
3 François Dorvault, L'Officine, Vigot, Paris, 1995, 2089 pages
4 Shu-Chiao Lin, Chih-Fen Huang, Li-Jiuan Shen, Hsueh-Ju Wang, Fe-Lin Lin Wu, Formulation and stability of an extemporaneous 0.02% chlorhexidine digluconate ophthalmic solution, Journal of the Formosan Medical Association, 114, 12, 2015, Pages 1162-1169
5 Daljit Kapoor, Navjot Kaur, Tarun Nanda, Efficacy of two different concentrations of chlorhexidine mouth-rinse on plaque re-growth, Indian Journal of Dentistry, 2, 2, 2011, Pages 11-15
6 Ana Carolina Magalhães, Annette Wiegand, Daniela Rios, Angélica Hannas, Marília Afonso Rabelo Buzalaf, Chlorhexidine and green tea extract reduce dentin erosion and abrasion in situ, Journal of Dentistry, 37, 12, 2009, Pages 994-998
7 V. P. A. Saboia, M. S. R. G. Araújo, L. C. Souza, F. M. Apolônio, A. D. Loguércio, Two-year clinical evaluation of primers containing chlorhexidine digluconate, Dental Materials, 30, Suppl 1, 2014, Pages e126-e127
8 H. Below, O. Assadian, R. Baguhl, U. Hildebrandt, A. Kramer, Measurements of chlorhexidine, p-chloroaniline, and p-chloronitrobenzene in saliva after mouth wash before and after operation with 0.2% chlorhexidine digluconate in maxillofacial surgery: a randomised controlled trial, British Journal of Oral and Maxillofacial Surgery, 55, 2, 2017, Pages 150-155
9 José A. Álvarez, Susana R. Ruíz, Juan L. Mosqueda, Ximena León, Juan H. Macias, Decontamination of stethoscope membranes with chlorhexidine: Should it be recommended?, American Journal of Infection Control, 44, 11, 2016, Pages e205-e209
10 C. Lafforgue, L. Carret, F. Falson, M. E. Reverdy, J. Freney, Percutaneous absorption of a chlorhexidine digluconate solution, International Journal of Pharmaceutics, 147, 2, 1997, Pages 243-246
11 Mariano Paternoster, Massimo Niola, Vincenzo Graziano, Avoiding Chlorhexidine Burns in Preterm Infants, Journal of Obstetric, Gynecologic & Neonatal Nursing, 46, 2, 2017, Pages 267-271
12 Iria Neri, Giulia Maria Ravaioli, Giacomo Faldella, Maria Grazia Capretti, Annalisa Patrizi, Chlorhexidine-Induced Chemical Burns in Very Low Birth Weight Infants, The Journal of Pediatrics, 191, 2017, Pages 262-265.e2
13 Daryl S. Paulson, Robert Topp, Robert E. Boykin, Gregory Schultz, Qingping Yang, Efficacy and safety of a novel skin cleansing formulation versus chlorhexidine gluconate, American Journal of Infection Control, 46, 11, 2018, Pages 1262-1265
14 Erna Snellman, Tapio Rantanen, Severe anaphylaxis after a chlorhexidine bath, Journal of the American Academy of Dermatology, 40, 5, 1999, Pages 771-772
15 Ahmed Al-Niaimi, Laurel W. Rice, Uppal Shitanshu, Bonnie Garvens, Nasia Safdar, Safety and tolerability of chlorhexidine gluconate (2%) as a vaginal operative preparation in patients undergoing gynecologic surgery, American Journal of Infection Control, 44, 9, 2016, Pages 996-998
16 Rohan Merani, Zachary E. McPherson, Alan P. Luckie, Jagjit S. Gilhotra, Peter E. Davies, Aqueous Chlorhexidine for Intravitreal Injection Antisepsis: A Case Series and Review of the Literature, Ophthalmology, 123, 12, 2016, Pages 2588-2594
17 Marion E Frank, Janneane F Gent, Thomas P Hettinger, Effects of chlorhexidine on human taste perception, Physiology & Behavior, 74, 1–2, 2001, Pages 85-99
18 H. U. Hepsø, T. Bjørnland, L. A. Skoglund, Side-effects and patient acceptance of 0.2% versus 0.1% chlorhexidine used as postoperative prophylactic mouthwash, International Journal of Oral and Maxillofacial Surgery, 17, 1, 1988, Pages 17-20
19 Antonio Bascones-Martínez, Marta Muñoz-Corcuera, Cristina Bascones-Ilundain, Sideeffects of drugs on the oral cavity, Medicina Clínica (English Edition),144, 3, 2015, Pages 126-131
20 Timothy J. Watts, Philip H. Li, Kok Loong Ue, Rubaiyat Haque, Chronic Allergic Contact Dermatitis Due to Chlorhexidine, The Journal of Allergy and Clinical Immunology: In Practice, 6, 1, 2018, Pages 254-255
21 Supriya Rastogi, Kevin R. Patel, Vivek Singam, Jonathan I. Silverberg, Allergic contact dermatitis to personal care products and topical medications in adults with atopic dermatitis, Journal of the American Academy of Dermatology, In press, corrected proof, Available online 25 July 2018
22 Günter Kampf, What is left to justify the use of chlorhexidine in hand hygiene?, Journal of Hospital Infection, 70, Suppl 1, 2008, Pages 27-34
23 David Spoerl, Peter Jandus, Thomas Harr, Pitfalls and peculiarities in chlorhexidine allergy, The Journal of Allergy and Clinical Immunology: In Practice, 4, 5, 2016, Pages 991-992
24 Brian J. Rasimick, Michelle Nekich, Megan M. Hladek, Barry L. Musikant, Allan S. Deutsch, Interaction between Chlorhexidine Digluconate and EDTA, Journal of Endodontics, 34, 12, 2008, Pages 1521-1523
Retour aux regards