> 02 mai 2022
Molécule neuroprotectrice, candidate pour des essais en matière de traitement de la maladie de Parkinson (et une de plus !),1,2 molécule intéressante dans le cadre de la prise en charge de certaines infections urinaires,3 du fait de sa capacité à s’hydrolyser en hydroquinone uro-antiseptique,4 ingrédient naturel à application dermatologique5 et en particulier à finalité dépigmentante,6 apprécié tout particulièrement depuis que l’hydroquinone est devenue persona non grata dans les cosmétiques (puisque l’on ne peut pas mettre d’hydroquinone dans les cosmétiques, pourquoi ne pas mettre un générateur d’hydroquinone en lieu et place ?),7 l’arbutine est également un actif anti-inflammatoire8 et antioxydant, très largement étudié.9 Présentée par certains comme un actif « éclaircissant de nouvelle génération »,10 l’arbutine ne peut pas ne pas poser question du fait de sa structure chimique.
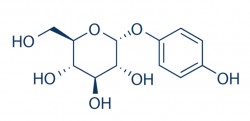
Sa structure chimique, un dérivé de sucre... et d’hydroquinone
L'arbutine est un composé possédant une structure chimique dans laquelle une molécule de D-glucose est liée à de l'hydroquinone.11 Le D-glucose existe sous forme α, β ou γ-anomère en solution aqueuse, le β-anomère étant une forme dominante. La β-arbutine (ce stéréoisomère est appelé couramment arbutine) dans laquelle l'anomère β du D-glucose est lié à l'hydroquinone se retrouve principalement dans la busserole et la poire, les deux substrats naturels les plus emblématiques. L'α-arbutine, quant à elle, est un composé d'hydroquinone et de l'anomère α du D-glucose.12
A l’inventaire européen, sont donc mentionnés deux isomères de l’arbutine : l’alpha-arbutine (la forme non présente dans la nature) (nom INCI : alpha-arbutin) aux propriétés « anti-oxydantes, blanchissantes, conditionneur cutané »)13 et la bêta-arbutine (forme naturellement présente dans la nature) (nom INCI : arbutin) aux propriétés identiques.14,15
Sa naturalité, plus ou moins grande… c’est selon...
Isolée pour la première fois en 1852, par Kawalier, dans les feuilles de busserole (Arctostaphylos uva ursi), la structure chimique de cette molécule (un glucoside d’hydroquinone) a été élucidée par Strecker, 6 ans plus tard.15 On retrouve également l’arbutine (sous forme bêta) dans les feuilles de serratule à 5 feuilles,16 dans celles du myrtillier (Vaccinium myrtilus), de l’airelle (V. vitis-idaea),17 dans les feuilles d’Atriplex littoralis,18 une plante qui sert à constituer des haies pour sentiers des douaniers sur notre littoral, mais également dans le tronc de l’arbousier19 ou encore dans des fruits comme la noix20 ou l’emblématique poire ! Le poivre de Sichuan (Xanthoxylum piperitum) en contient également au niveau du péricarpe et de la graine.21 Idem pour le plat de lentilles qui en renferme de petites quantités.22
Mais revenons à la poire. Présente dans la poire (un jus de poire « classique » peut en renfermer 2 % v/v), l’arbutine constitue une molécule très utile pour les inspecteurs des services des fraudes qui peuvent détecter à coup sûr des jus de pommes adultérés à l’aide de jus de poires23,24 ou de la confiture de coing adultérée de la même manière.25 Si vous trouvez de l’arbutine dans votre jus de pommes ou dans votre confiture de coing, c’est qu’il y a de la poire à l’horizon ! Sachez, qu’il existe également des poires de compétition d’origine coréenne renfermant jusqu’à 20 fois plus d’arbutine qu’une poire cultivée en Chine ou en Afrique du sud. L’arbutine se concentre en particulier dans la peau de la poire où elle se trouve à une concentration 45 fois plus importante que dans la pulpe...26 De quoi faire apprécier les déchets aux chercheurs d’arbutine à faible coût et à caractère éco-responsable marqué.
Mode d’obtention, plusieurs voies possibles
L’arbutine se trouvant naturellement dans un certain nombre de végétaux, il est possible d’en réaliser l’extraction au prix de quelques efforts. Il est également possible d’en synthétiser à partir de l’hydroquinone ou d’obtenir, par voie enzymatique, son glucoside à l’aide d’enzymes comme les amylosaccharases, par exemple.27,28 On peut également avoir recours à la biotechnologie en faisant fermenter du soja par des bactéries amoureusement entraînées pour la chose (Bacillus subtilis, par exemple).29
Mécanisme d’action dépigmentant/éclaircissant
L'arbutine a pour effet de réduire la teneur en mélanine (le pigment responsable de la couleur de la peau) à une concentration non cytotoxique pour les mélanocytes humains en culture.30 Certains auteurs ont montré que l’arbutine était capable de réduire, de manière dose-dépendante, l’activité de la tyrosinase (l’enzyme-clé responsable de la transformation de la tyrosine en mélanine) et que cet effet inhibiteur à la dose de 0,5 mM était plus important que celui observé avec l’acide kojique ou la vitamine C employé à la même dose. Toutefois, il est bon de préciser que cet avis reste assez isolé, puisque d’autres études in vitro (sur tyrosinase de champignon) montrent que pour obtenir le même niveau d’inhibition (50 %) il faut une concentration en arbutine 83 fois plus élevée que celle nécessaire pour l’acide kojique et 50 fois plus élevée que celle de la vitamine C ! On considère que l’arbutine constitue un inhibiteur compétitif de la tyrosinase, une sorte de leurre donc qui trompe l’enzyme et l’empêche ainsi de « fonctionner ». On retiendra le fait que l’alpha-arbutine est 10 fois plus efficace que la bêta-arbutine.31 Dans le match synthèse-nature, le point est donc royalement attribué à l’équipe « synthèse » !
Autre mécanisme d’action évoqué : la libération d’hydroquinone au niveau cutané, en particulier sous l’action de certaines bactéries de la flore cutanée ou sous l’action des rayonnements ultra-violets.12
Pour résumé, l’arbutine serait donc susceptible d’agir comme un agent blanchissant, par un effet propre (l’arbutine étant par elle-même un inhibiteur de la tyrosinase) et en agissant comme une sorte de « prodrogue » (l’arbutine serait susceptoble, dans certaines conditions, de générer de l’hydroquinone, une molécule dépigmentante de référence). Il est toutefois bon de savoir que cette libération d’hydroquinone fait causer les chercheurs, les uns déniant le phénomène, les autres le quantifiant !
Sécurité d’emploi, bof bof
En matière de sécurité d’emploi, il est important de rappeler que le mécanisme d’action de l’arbutine repose (tout au moins en partie) sur l’hydrolyse de cette molécule avec libération d’hydroquinone au niveau cutané. Or, l’hydroquinone est interdite pour un usage cutané (on la trouve listée en Annexe II du règlement (CE) N°1223/2009, à l’entrée 1339) et autorisée dans une seule catégorie de cosmétiques, les produits professionnels correspondant aux ongles artificiels, au niveau européen pour des raisons toxicologiques. Le SCCS émet à ce sujet un avis négatif à l’encontre des générateurs d’hydroquinone qui contournent la réglementation de manière étonnante et préconise la mise en place de doses limites d’emploi (en se basant sur le fait que l’absorption cutanée de l’alpha-arbutine est faible - seulement 0,53 % de l’arbutine appliquée sur la peau - et sur le fait que le métabolisme cutané permet la transformation de 20 % de l’arbutine, quelle que soit son isoforme, absorbée par la peau). Dans ces conditions, le SCCS préconise l’établissement de doses limites d’emploi pour l’alpha-arbutine (2 % pour une crème destinée au visage et 0,5 % pour une préparation destinée au corps).32 Pour la bêta-arbutine, l’avis émis antérieurement concluait à une absence de sécurité d’emploi de cet ingrédient éclaircissant.33 Il convient aussi de se souvenir du fait que l’arbutine, selon les formules considérées et selon les conditions de stockage, est susceptible de donner naissance à de l’hydroquinone.12 On ne pourra, à ce niveau, que répéter la nécessité d’apposer systématiquement sur les produits cosmétiques et sur les produits éclaircissants en particulier une date de péremption qui permet de s’assurer que le produit n’est pas resté de longues années oublié sur une étagère.
L’arbutine, en bref
Raisins d’ours (Arctostaphylos-uva-ursi), poires, fruits divers et feuilles variées, ingrédients naturels susceptibles d’être mis en avant pour la prise en charge d’hyperpigmentations variées...34 les arguments en faveur de l’arbutine sonnent bien dans un monde où l’on aime se voiler la face et croire que tout ce qui est naturel est forcément bon pour la santé ! Tout serait parfait si l’on ne se penchait pas trop sur la structure chimique de ce que l’on peut appeler benoitement un « dérivé de sucre », si l’on veut faire passer la pilule en douceur ou bien « dérivé d’hydroquinone » si l’on souhaite alerter au sujet d’un ingrédient qui, pour l’heure, contrevient à la réglementation en toute discrétion. Il fallait le dire ! Il faut le savoir, lorsque l’on utilise une crème à base d’arbutine dont la dose d’emploi est laissée, actuellement, à la libre appréciation de la personne responsable de la mise sur le marché, on risque fort de se retrouver avec de l’hydroquinone sur la peau. A savoir, histoire de ne pas être la poire !
Bibliographie
1 Zhao J, Kumar M, Sharma J, Yuan Z. Arbutin effectively ameliorates the symptoms of Parkinson's disease: the role of adenosine receptors and cyclic adenosine monophosphate. Neural Regen Res. 2021 Oct;16(10):2030-2040
2 Ding Y, Kong D, Zhou T, Yang ND, Xin C, Xu J, Wang Q, Zhang H, Wu Q, Lu X, Lim K, Ma B, Zhang C, Li L, Huang W. α-Arbutin Protects Against Parkinson's Disease-Associated Mitochondrial Dysfunction In Vitro and In Vivo. Neuromolecular Med. 2020 Mar;22(1):56-67
3 Afshar K, Fleischmann N, Schmiemann G, Bleidorn J, Hummers-Pradier E, Friede T, Wegscheider K, Moore M, Gágyor I. Reducing antibiotic use for uncomplicated urinary tract infection in general practice by treatment with uva-ursi (REGATTA) - a double-blind, randomized, controlled comparative effectiveness trial. BMC Complement Altern Med. 2018 Jul 3;18(1):203
4 Jurica K, Karačonji IB, Šegan S, Opsenica DM, Kremer D. Quantitative analysis of arbutin and hydroquinone in strawberry tree (Arbutus unedo L., Ericaceae) leaves by gas chromatography-mass spectrometry. Arh Hig Rada Toksikol. 2015 Sep 1;66(3):197-202
5 Baumann L, Woolery-Lloyd H, Friedman A. "Natural" ingredients in cosmetic dermatology. J Drugs Dermatol. 2009 Jun;8(6 Suppl):s5-9
6 Zhu W, Gao J. The use of botanical extracts as topical skin-lightening agents for the improvement of skin pigmentation disorders. J Investig Dermatol Symp Proc. 2008 Apr;13(1):20-4
7 O'Donoghue JL. Hydroquinone and its analogues in dermatology - a risk-benefit viewpoint. J Cosmet Dermatol. 2006 Sep;5(3):196-203
8 Cacchio A, Di Carlo G, Vincenza C, De Blasis E. Effectiveness and safety of a mixture of diosmin, coumarin and arbutin (Linfadren®) in addition to conventional treatment in the management of patients with post-trauma/surgery persistent hand edema: a randomized controlled trial. Clin Rehabil. 2019 May;33(5):904-912
9 Nalban N, Sangaraju R, Alavala S, Mir SM, Jerald MK, Sistla R. Arbutin Attenuates Isoproterenol-Induced Cardiac Hypertrophy by Inhibiting TLR-4/NF-κB Pathway in Mice. Cardiovasc Toxicol. 2020 Jun;20(3):235-248
10 http://www.biolissime.fr/blog/lalpha-arbutine-lactif-eclaircissant-nouvelle-generation/
11
12 Boo YC. Arbutin as a Skin Depigmenting Agent with Antimelanogenic and Antioxidant Properties. Antioxidants (Basel). 2021 Jul 15;10(7):1129
13 https://ec.europa.eu/growth/tools-databases/cosing/index.cfm?fuseaction=search.details_v2&id=54359
14 https://ec.europa.eu/growth/tools-databases/cosing/index.cfm?fuseaction=search.details_v2&id=74362
15 Zhou H, Zhao J, Li A, Reetz MT. Chemical and Biocatalytic Routes to Arbutin †. Molecules. 2019 Sep 11;24(18):3303
16 Morag M, Nawrot J, Siatkowski I, Adamski Z, Fedorowicz T, Dawid-Pac R, Urbanska M, Nowak G. A double-blind, placebo-controlled randomized trial of Serratulae quinquefoliae folium, a new source of β-arbutin, in selected skin hyperpigmentations. J Cosmet Dermatol. 2015 Sep;14(3):185-90
17 Ștefănescu BE, Szabo K, Mocan A, Crişan G. Phenolic Compounds from Five Ericaceae Species Leaves and Their Related Bioavailability and Health Benefits. Molecules. 2019 May 29;24(11):2046. doi: 10.3390/molecules24112046
18 Gođevac D, Stanković J, Novaković M, Anđelković B, Dajić-Stevanović Z, Petrović M, Stanković M. Phenolic Compounds from Atriplex littoralis and Their Radiation-Mitigating Activity. J Nat Prod. 2015 Sep 25;78(9):2198-204
19 Jurica K, Brčić Karačonji I, Kopjar N, Shek-Vugrovečki A, Cikač T, Benković V. The effects of strawberry tree water leaf extract, arbutin and hydroquinone on haematological parameters and levels of primary DNA damage in white blood cells of rats. J Ethnopharmacol. 2018 Apr 6;215:83-90
20 Fuentealba C, Hernández I, Saa S, Toledo L, Burdiles P, Chirinos R, Campos D, Brown P, Pedreschi R. Colour and in vitro quality attributes of walnuts from different growing conditions correlate with key precursors of primary and secondary metabolism. Food Chem. 2017 Oct 1;232:664-672
21 Hisatomi E, Matsui M, Kubota K, Kobayashi A. Antioxidative activity in the pericarp and seed of Japanese pepper (Xanthoxylum piperitum DC). J Agric Food Chem. 2000 Oct;48(10):4924-8
22 Tsopmo A, Muir AD. Chemical profiling of lentil (Lens culinaris Medik.) Cultivars and isolation of compounds. J Agric Food Chem. 2010 Aug 11;58(15):8715-21
23 Thavarajah P, Low NH. Adulteration of apple with pear juice: emphasis on major carbohydrates, proline, and arbutin. J Agric Food Chem. 2006 Jun 28;54(13):4861-7
24 Willems JL, Low NH. Structural identification of compounds for use in the detection of juice-to-juice debasing between apple and pear juices. Food Chem. 2018 Feb 15;241:346-352
25 Silva BM, Andrade PB, Mendes GC, Valentão P, Seabra RM, Ferreira MA. Analysis of phenolic compounds in the evaluation of commercial quince jam authenticity. J Agric Food Chem. 2000 Jul;48(7):2853-7
26 Hong SY, Lansky E, Kang SS, Yang M. A review of pears (Pyrus spp.), ancient functional food for modern times. BMC Complement Med Ther. 2021 Sep 1;21(1):219
27 Agarwal N, Rai AK, Singh SP. Biotransformation of hydroquinone into α-arbutin by transglucosylation activity of a metagenomic amylosucrase. 3 Biotech. 2021 Aug;11(8):362
28 Zhu L, Xu M, Lu C, Chen L, Xu A, Fang J, Chen H, Lu Y, Fan Y, Chen X. Optimization of whole-cell biotransformation for scale-up production of α-arbutin from hydroquinone by the use of recombinant Escherichia coli. AMB Express. 2019 Jun 28;9(1):94. doi: 10.1186/s13568-019-0820-7
29 Jin YH, Jeon AR, Mah JH. Tyrosinase Inhibitory Activity of Soybeans Fermented with Bacillus subtilis Capable of Producing a Phenolic Glycoside, Arbutin. Antioxidants (Basel). 2020 Dec 18;9(12):1301
30 Maeda K, Fukuda M. Arbutin: mechanism of its depigmenting action in human melanocyte culture. J Pharmacol Exp Ther. 1996 Feb;276(2):765-9
31 Zhu X, Tian Y, Zhang W, Zhang T, Guang C, Mu W. Recent progress on biological production of α-arbutin. Appl Microbiol Biotechnol. 2018 Oct;102(19):8145-8152
32 https://ec.europa.eu/health/scientific_committees/consumer_safety/docs/sccs_o_176.pdf
33 https://ec.europa.eu/health/ph_risk/committees/04_sccp/docs/sccp_o_134.pdf
34 Alexis AF, Blackcloud P. Natural ingredients for darker skin types: growing options for hyperpigmentation. J Drugs Dermatol. 2013 Sep;12(9 Suppl):s123-7
Retour aux regards